核准日期:2006年12月30日
修改日期:
2010年01月26日 发明专利 专利号:ZL2012 1 0018074.9
2013年03月18日 发明专利 专利号:ZL2012 1 0018812.X
2018年03月27日
匹多莫德口服溶液说明书
请仔细阅读说明书并在医师指导下使用
【药品名称】
通用名称:匹多莫德口服溶液
商品名称:芙露饮
英文名称:Pidotimod Oral Solution
汉语拼音:Piduomode Koufu Rongye
【成份】
本品主要成份为:匹多莫德。
其化学名称为:(R)-3-[(S)-(5-氧-2-吡咯烷基)羰基]-噻唑烷-4-羧酸。
其化学结构式为:
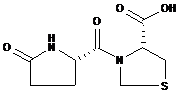
分子式:C9H12N2O4S
分子量:244.26
【性状】本品为无色或微黄色的澄明液体,无臭,味微甜酸。
【适应症】用于慢性或反复发作的呼吸道感染和尿路感染的辅助治疗。
【规格】(1)10ml:0.2g (2)10ml:0.4g
【用法用量】
口服给药。
3岁及以上儿童及青少年:每次0.4g,每日两次,不超过60天。
成人:每次0.8g,每日两次,不超过60天。
【不良反应】上市后监测和文献资料可观察到以下不良反应:
1. 消化系统损害:偶见恶心、呕吐、腹泻、腹痛、胃部不适、口干、腹胀、食欲异常、胃灼热等,罕见肝脏氨基转移酶升高等;
2. 皮肤及其附件损害:偶见可致皮肤过敏(包括皮疹和瘙痒)、皮肤潮红等;严重者可罕见皮肤、粘膜溃疡;
3. 神经系统损害:偶见头晕、头痛、眩晕等;
4. 其他:偶见胸闷、发热、嗜睡、心悸、面部水肿、唇部水肿等,罕见过敏性紫癜、过敏性休克等。
【禁忌】1. 对本品过敏者禁用。2. 3岁以下儿童禁用。3. 妊娠3个月内妇女禁用。4. 遗传性果糖不耐受,葡萄糖-半乳糖吸收不良患者禁用。
【注意事项】1. 用药前应仔细询问患者用药史和过敏史,过敏体质患者慎用。2. 先天性免疫缺陷(高IgE综合征)患者慎用。3. 由于食物会干扰本品的吸收,须空腹服用。4. 使用本品期间,如出现任何不良事件和/或不良反应,请咨询医生。
【孕妇及哺乳期妇女用药】尚未有孕妇和哺乳妇女用药方面资料。尽管动物实验无生殖毒性,仍不宜用。妊娠3个月内妇女禁用。
【儿童用药】本品可用于3岁及以上儿童及青少年患者,详见【用法用量】。3岁以下儿童禁用。
【老年用药】未进行该项实验且无可靠参考文献。
【药物相互作用】药物可能影响抑制或诱导淋巴细胞功能活性,或影响免疫系统活性的药物的效力。
【药物过量】尚未有使用本品药物过量的报道,如遇药物过量,则需用常规方法如催吐、导泻、输液等促进过量药物排出。
【药理毒理】
药理作用:本品是一种人工合成的口服免疫刺激剂,通过刺激和调节细胞介导的免疫反应而起作用。
毒理研究:重复给药毒性:大鼠连续52周灌服本品200、400、800mg/kg/日,中、高剂量组雌性动物体重明显增加,800mg/kg/日(按体表面积折算,相当于临床推荐最大剂量的4.9倍)组动物尿pH值和尿蛋白增高,组织学检查可见高剂量组雄性动物颈淋巴结外皮层细胞增加,少数雌性动物胃、十二指肠膨大部分粘膜增生,可能与给药有关。大鼠连续4周灌服本品1200mg/kg/日(按体表面积折算,相当于临床推荐最大剂量的7.3倍),可引起少数动物腹泻、镇静、反应性降低、活动减少和甲状腺轻度增大,但无组织学改变。Beagle犬连续52周灌服本品,剂量达600mg/kg/日(按体表面积折算,相当于临床推荐最大剂量的12.2倍)时,偶见少数动物腹泻、肾脏重量增加、肾小管轻微扩张和间质纤维增生,血清尿素氮和肌酐轻微增加。
遗传毒性:本品A mes试验、L5178Y细胞基因突变试验、CHO细胞染色体畸变试验、哺乳动物Hela S3细胞DNA损伤试验和小鼠微核试验结果均为阴性。
生殖毒性:一般生殖毒性:雌、雄SD大鼠经口给予本品剂量达600mg/kg/日(按体表面积折算,相当于临床推荐最大剂量的3.6倍),对生殖力无影响,对F1和F2代仔鼠的生育力、躯体运动、行为和神经发育也无影响。
致畸敏感期毒性:致畸敏感期雌性SD大鼠灌服剂量达600mg/kg/日时,未见致畸性;静注250、500和1000mg/kg/日时,母鼠的摄食量减少、体重增加减慢。中、高剂量组动物着床率下降,但对胚胎发育无明显影响,无毒性反应剂量为250mg/kg/日(按体表面积折算,相当于临床推荐日注射量的12.2倍)。新西兰兔在致畸敏感期灌服剂量达300mg/kg/日、静注剂量达500mg/kg/日,均未见致畸性。
围产期毒性:SD大鼠从妊娠第16天至产后第21天连续灌服剂量达600mg/kg/日、静注剂量达500mg/kg/日,对母鼠的一般状况、生育情况、F1代子鼠的存活、生长发育等均无影响。
【药代动力学】
本品口服吸收迅速,人体口服生物利用度为45%,半衰期为4小时,以原型(静脉给药剂量的95%)经尿液排泄。与禁食状态下给药相比,与食物同时口服时,生物利用度降低50%,血浆浓度达到最大值时晚2小时。
本品完全经尿液排出,肾功能不全者消除半衰期延长。严重的肾功能不全(血浆肌酐浓度5mg/dl),匹多莫德的消除半衰期不超过8〜9小时。尚未进行肝功能不全患者的研究,因为本品几乎完全以原型经尿液排泄。
【贮藏】密封,在阴凉处(不超过20℃)保存。
【有效期】24个月
【包装】
低硼硅玻璃管制口服液体瓶(棕色),
(1)10ml:0.2g 10ml/支×6支/盒或8支/盒或10支/盒或12支/盒;
(2)10ml:0.4g 10ml/支×6支/盒或8支/盒或10支/盒或12支/盒,20ml/支×6支/盒。
钠钙玻璃管制口服液体瓶(棕色),
10ml:0.4g 10ml/支×6支/盒或8支/盒或10支/盒或12支/盒,20ml/支×6支/盒。
【执行标准】国家食品药品监督管理总局国家药品标准WS-981(X-735)-2002-2014Z
【批准文号】(1)10ml:0.2g 国药准字H20030464 (2)10ml:0.4g 国药准字H20030463
【上市许可持有人】企业名称:江苏吴中医药集团有限公司苏州制药厂
注册地址:苏州市吴中区东吴南路2-1号
【生产企业】
企业名称:江苏吴中医药集团有限公司苏州制药厂
生产地址:苏州市吴中区东吴南路2-1号
邮政编码:215168
电话号码:0512-65256080 65251551
传真号码:0512-66262681
网 址:http://www.wzyy.cn




